La publication du décret n° 2024-795 du 8 juillet 2024 relatif aux investigations cliniques et aux études des performances (JORF du 13 Juillet 2024) démontre une nouvelle fois l’absence de cohérence du cadre juridique de la recherche clinique française.
Les définitions des recherches portant sur des dispositifs médicaux, et qui conditionnent tout un ensemble législatif et réglementaire, sont fixées par ce décret ! Comme nous le démontrons dans cet article, cela n’est pas si anodin qu’il n’y paraît.
1. On ne transpose pas un règlement !
À la lecture des ordonnances n°2022-582 et n°2022-1086 et du décret d’application des dispositions issues de ces ordonnances publié le 13 juillet 2024 (Décret n° 2024-795 précité), nous pouvons penser qu’il s’agit de dispositions nationales venant transposer une directive européenne.
En effet, tant par le volume que ces textes représentent, que par leur contenu, il est difficile d’imaginer qu’il s’agit en réalité de venir préciser quelques dispositions d’un règlement européen afin de faciliter sa mise en œuvre.
Les rédacteurs de ces textes nationaux ne semblent pas maitriser parfaitement la différence entre une directive et un règlement, et c’est bien regrettable.
En effet, les autres pays européens maitrisent mieux ces nuances et proposent un encadrement juridique des essais cliniques, des investigations cliniques et des études des performances beaucoup plus attractif, car centré exclusivement sur les règlements européens !
La production législative et réglementaire inutile apporte de la confusion, de la complexité et fait fuir tout promoteur à la recherche de stabilité et d’unicité réglementaire européenne.
Pire, on utilise un texte réglementaire (un décret) pour définir des concepts essentiels (les catégories de recherches) qui sont censés guider la compréhension d’obligations législatives et réglementaires.
Est-ce que le concept de la hiérarchie des normes évoque quelque chose aux rédacteurs de ces ordonnances et de ce décret ?
Je m’explique : la logique juridique veut qu’un texte de niveau supérieur (Loi) définisse les concepts qui vont ensuite être détaillés dans les dispositions d’un niveau équivalent puis être précisés par des textes d’application de niveau inférieur (décret et arrêté).
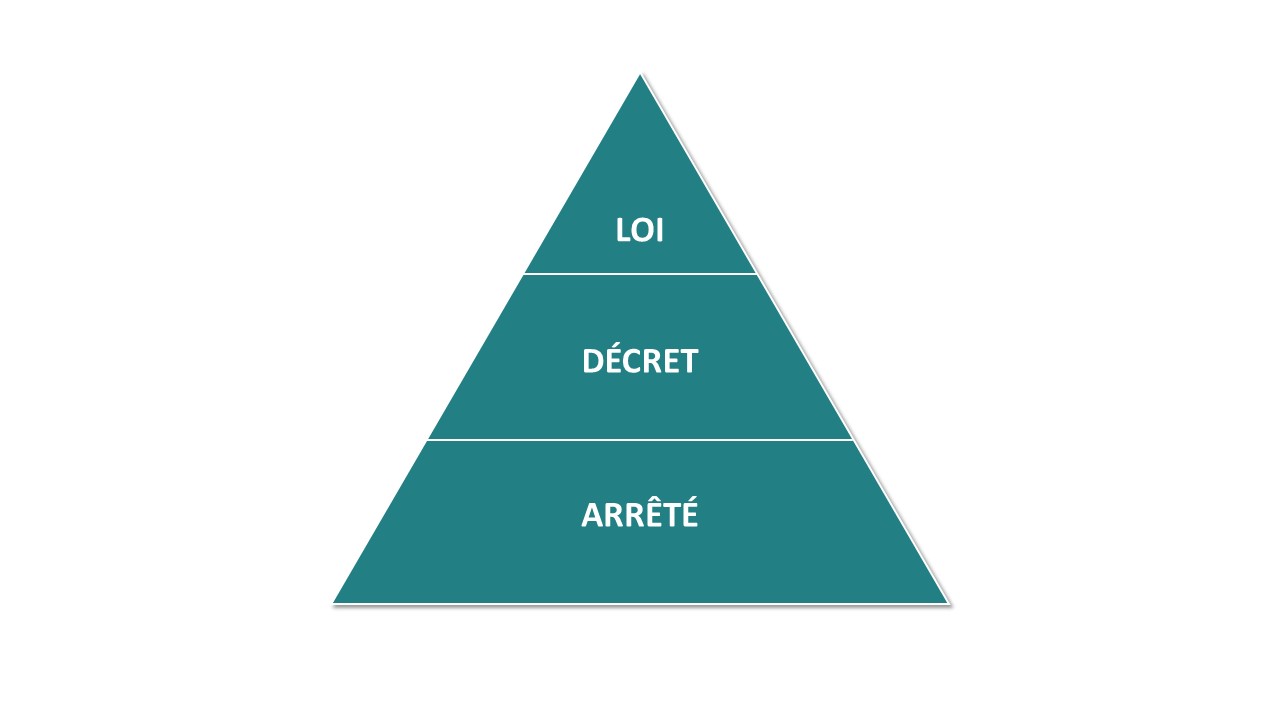
À titre d’illustration, l’article L. 1121-1 du CSP (issu d’une loi) définit les recherches impliquant la personne humaine puis ses différentes sous-catégories telles que les recherches interventionnelles (RIPH 1). Les articles suivants viennent préciser les obligations devant être respectées lors de l’initiation et la conduite de recherches interventionnelles.
Ensuite des textes réglementaires (décrets et arrêtés) viennent préciser les modalités de mise en œuvre de ces obligations.
3. Consulter 1 article et obtenir une réponse c’est plus simple que devoir en consulter 3, non ?
Prenons l’exemple de l’obligation de contracter une assurance pour le promoteur d’une RIPH 1.
« Article L1121-10
(…)
Toute recherche mentionnée aux 1° ou 2° de l’article L. 1121-1 exige la souscription préalable, par son promoteur, d’une assurance garantissant sa responsabilité civile telle qu’elle résulte du présent article et celle de tout intervenant, indépendamment de la nature des liens existant entre les intervenants et le promoteur. Les dispositions du présent article sont d’ordre public. (…) »
La lecture de cette disposition législative permet d’identifier immédiatement que la conduite d’une RIPH 1 (recherche mentionnée au 1° de l’article L. 1121-1 du CSP) nécessite de contracter une assurance couvrant la réalisation du protocole.
C’est donc une construction juridique efficace.
Prenons maintenant les dispositions identiques relatives aux investigations cliniques.
« Article L1125-9
(…)
Toute investigation clinique à l’exception de celle qui ne comporte aucun risque ni contrainte et dans laquelle tous les actes sont réalisés et les produits utilisés de manière habituelle exige la souscription préalable, par son promoteur, d’une assurance garantissant sa responsabilité civile telle qu’elle résulte du présent article et celle de tout intervenant, indépendamment de la nature des liens existant entre les intervenants et le promoteur. Les dispositions du présent article sont d’ordre public. (…) »
Force est de constater qu’à la lecture de cet article législatif, il est difficile (voire impossible) d’identifier les investigations cliniques concernées par cette obligation d’assurance.
Les rédacteurs de cet article auraient dû se référer aux catégories d’investigations cliniques définies par le Règlement (UE) 2017/745 pour identifier clairement celles concernées par cette obligation d’assurance. S’agissait-il des investigations cliniques de l’article 62, celles de l’article 82 ou des investigations SCAC mentionnées à l’article 74, etc. ?
Compte tenu de la mauvaise rédaction de l’article L. 1125-9, qui n’est d’aucune utilité, car n’apportant aucune réponse claire, comment s’en sortir ?
Le réécrire en précisant les catégories d’investigations cliniques concernées, mentionnées dans le Règlement, afin de disposer d’une disposition aussi efficace et conforme à la logique juridique que l’article L. 1121-1 ?
En fait, en France on ne sait pas défaire ce qui a été mal fait.
Notre administration ne saurait-elle pas se remettre en cause ? En tout cas, cela fait des années qu’elle mène une politique « rustine » conduisant à la création d’un magnifique patchwork, mais dénué de toute lisibilité et inutilement complexe.
Donc pour « corriger » le tir, il a été décidé d’apporter les précisions nécessaires par l’intermédiaire de l’article R. 1125-17 du CSP.
« Article R1125-17
Le promoteur assume l’indemnisation des conséquences dommageables de l’investigation clinique pour la personne qui s’y prête et celle de ses ayants droit, dans les conditions prévues à l’article L. 1125-9.
Les promoteurs des investigations cliniques à l’exception de celles mentionnées aux a et b du 4° de l’article R. 1125-1, sont soumis à une obligation d’assurance. »
À la lecture de cet article, un lecteur averti ne sait toujours pas quelles sont les investigations cliniques concernées par l’obligation d’assurance. En effet, il est invité à aller consulter l’article R. 1125-1 du CSP.
Il convient donc de consulter 3 articles pour arriver à identifier les investigations cliniques concernées par l’obligation d’assurance, là où un seul suffirait.
Voilà la démonstration d’un système juridique inutilement complexe qui nécessite d’être simplifié sans délai !
4. Comment retrouver de la simplicité ?
Tout d’abord il conviendrait de retrouver une logique juridique, certains diraient un peu de cohérence.
On ne définit pas des concepts juridiques, et en l’espèce des catégories de recherche, dans des dispositions réglementaires.
À la lecture de l’article L. 1125-31 du CSP, nous pouvons d’ailleurs nous interroger fortement sur la légalité même des définitions proposées par l’article R. 1125-1 du CSP.
« Article L. 1125-31
Les modalités d’application des dispositions du présent chapitre sont déterminées par décret en Conseil d’Etat et notamment :
1° Les modalités applicables à la procédure d’évaluation coordonnée décrite à l’article 78 du règlement (UE) 2017/745 du Parlement européen et du Conseil du 5 avril 2017 ;
2° Les conditions applicables aux recours prévus à l’article L. 1125-4 ;
3° Les minima de garanties pour l’assurance prévue au troisième alinéa de l’article L. 1125-9 ;
4° Les conditions de prise en charge des dispositifs médicaux faisant l’objet d’investigations cliniques à finalité non commerciale prévue à l’article L. 1125-15 ;
5° Les conditions applicables aux investigations cliniques incluant le traitement de données à caractère personnel prévues à l’article L. 1125-19. »
Cette disposition législative ne prévoit pas la capacité pour un décret de venir préciser ce que constituent des investigations cliniques au sens du Règlement (UE) 2017/745. C’est pourtant ce que fait le décret n° 2024-795 en créant l’article R. 1125-1 du CSP :
« Article R1125-1
Pour l’application des dispositions du présent chapitre, constituent des investigations cliniques au sens du 45 de l’article 2 du règlement (UE) 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux : (…) »
Le décret va donc au-delà du périmètre qui lui était confié par la loi.
S’agissant d’un décret en Conseil d’Etat, ce dernier disposait de l’occasion de censurer cette illégalité en rappelant au ministère de la Santé qu’il devait rester dans une certaine légalité, quand bien même leur précédent texte était mal rédigé.
Car oui, cette situation découle directement d’une très mauvaise rédaction de l’ordonnance n° 2022-582, que nous avons pu souligner dans la partie 1 de notre Livre bleu consacré à la simplification de l’encadrement juridique de la recherche clinique (« L’usage catastrophique des ordonnances par le Gouvernement », p. 16).
Si le ministère de la Santé avait voulu réécrire les catégories d’investigations cliniques définies par le Règlement (UE) n°2017/745 (ce qui est contraire au principe de primauté des règlements européens !), il aurait dû procéder à cette reformulation au niveau législatif, donc par l’intermédiaire de l’ordonnance.
Seulement une fois que le Gouvernement perd son habilitation à prendre des dispositions législatives par voie d’ordonnances (c’est assez encadré !), pour pouvoir modifier des dispositions législatives, il doit alors s’en remettre au pouvoir législatif.
Le schéma est simple, il rédige un projet de loi et l’adresse au Parlement.
Voilà comment des erreurs législatives doivent être réparées et ce n’est certainement pas en intégrant ces dispositions dans un décret !
⇒ Thomas ROCHE, Avocat associé





