Il ne s’agit pas là d’une grande nouveauté, mais seulement d’une clarification bienvenue, apportée par le décret n°2024-795 du 8 juillet 2024 relatif aux investigations cliniques et aux études des performances (JORF du 13 juillet 2024).
Peut-on espérer qu’il s’agisse d’une première étape de clarification et qu’il en sera de même pour les recherches impliquant la personne humaine (RIPH) portant sur des médicaments à usage humain ?
1. Une clarification bienvenue
Le décret n°2024-795 est venu supprimer le deuxième alinéa de l’article R. 1121-1-1 du Code de la santé publique.
Ce deuxième alinéa était rédigé en ces termes :
« Les recherches impliquant la personne humaine portant sur un dispositif médical sont entendues comme toute investigation clinique d’un ou plusieurs dispositifs médicaux visant à déterminer ou à confirmer leurs performances ou à mettre en évidence leurs effets indésirables et à évaluer si ceux-ci constituent des risques au regard des performances assignées au dispositif. »
La suppression de cet alinéa permet donc de considérer qu’il n’existe plus de RIPH pouvant porter sur un dispositif médical.
Cette suppression vient régulariser et clarifier une situation d’ores et déjà actée depuis l’entrée en application du Règlement (UE) 2017/745 relatif aux dispositifs médicaux.
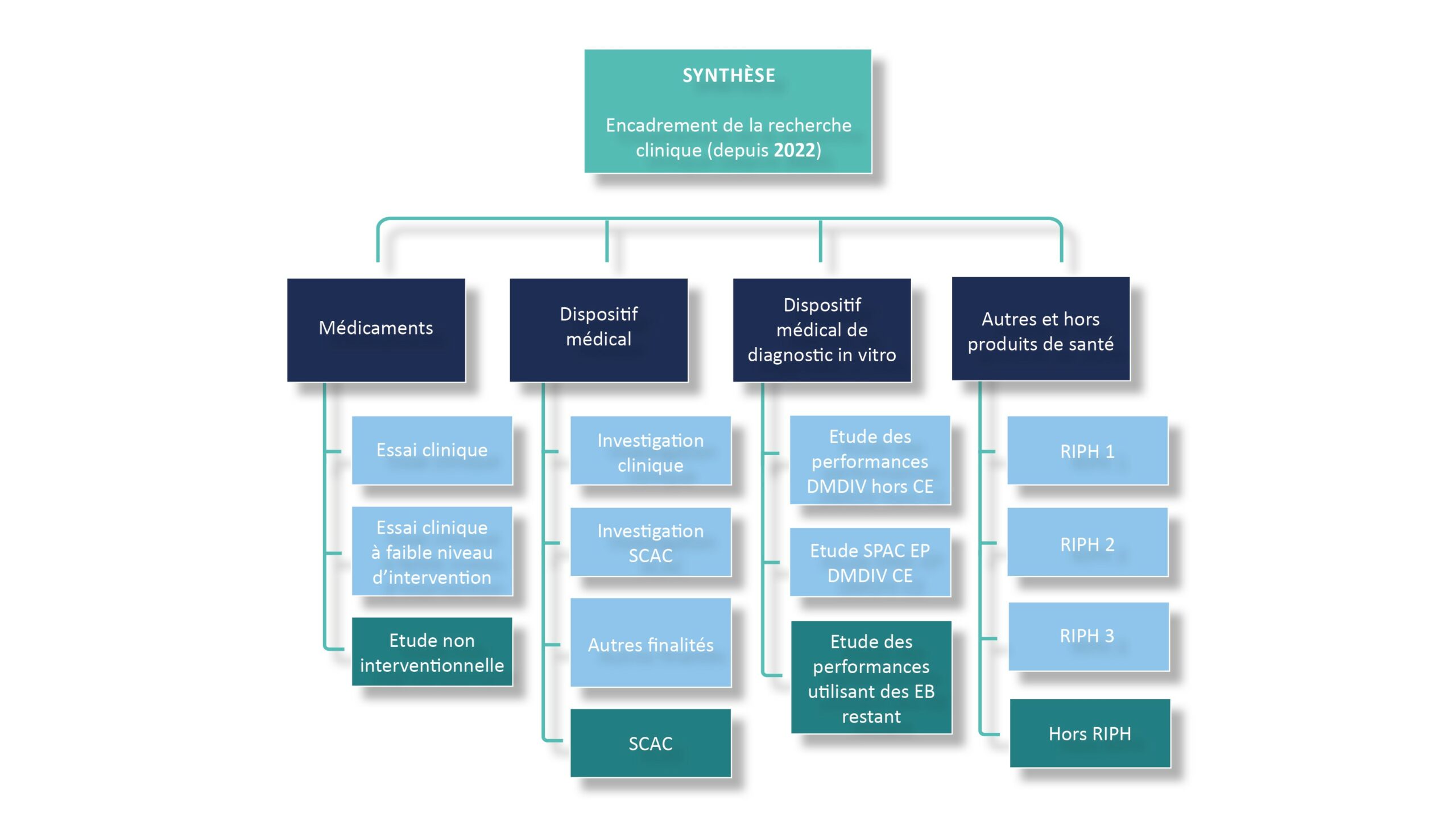
En effet, depuis le 26 mai 2021, les dispositions du Règlement relatif aux dispositifs médicaux s’appliquent à l’ensemble des nouvelles investigations cliniques et le principe de primauté du droit européen conduit à écarter toute législation nationale qui entrerait en concurrence avec ce cadre européen.
Il était donc attendu avec impatience un toilettage de la réglementation française afin d’éviter toutes confusions dans l’esprit des promoteurs et autres acteurs de la recherche clinique.
Ce toilettage a conduit également à supprimer le terme « dispositifs médicaux » à l’article R. 1121-2 du CSP.
Nous saluons donc la disparition des RIPH portant sur les dispositifs médicaux, mais nous ne comprenons pas pourquoi le régulateur n’est pas allé au bout de sa démarche.
2. Une clarification malheureusement partielle ?
Pour quelle raison le régulateur français, prenant acte du principe de primauté du droit européen pour la réglementation relative aux investigations cliniques de dispositifs médicaux, n’applique-t-il pas ce même principe aux recherches cliniques portant sur un médicament ?
En d’autres termes, pourquoi avoir supprimé, par l’intermédiaire du décret n° 2024-795, le deuxième alinéa de l’article R. 1121-1-1 du CSP et ne pas avoir supprimé le premier alinéa qui définit les RIPH portant sur un médicament ?
Ainsi, lorsque l’on consulte l’article R. 1121-1-1 du CSP, demeure une définition hors propos, celle des RIPH portant sur un médicament :
« Les recherches impliquant la personne humaine portant sur un médicament sont entendues comme toute recherche portant sur un ou plusieurs médicaments n’entrant pas dans le champ d’application de l’article premier du règlement (UE) n° 536/2014 du Parlement européen et du Conseil du 16 avril 2014 relatif aux essais cliniques de médicaments à usage humain et abrogeant la directive 2001/20/ CE. Elles visent à mettre en évidence ou à vérifier les effets cliniques, pharmacologiques et les autres effets pharmacodynamiques de ces médicaments ou à mettre en évidence tout effet indésirable, ou à en étudier l’absorption, la distribution, le métabolisme et l’élimination, dans le but de s’assurer de leur innocuité ou de leur efficacité. La décision de prescription du ou des médicaments est indépendante de celle d’inclure dans le champ de la recherche la personne qui se prête à celle-ci. »
Comme nous avons pu l’expliquer dans un livre bleu consacré à la simplification du cadre juridique de la recherche clinique, une telle catégorie de recherche doit être considérée comme illégale (« 1.1 Illégalité des recherches impliquant la personne humaine portant sur un médicament », p. 9).
Il ne peut pas exister de recherches portant sur des médicaments n’entrant pas dans le champ d’application du Règlement (UE) n°536/2014 relatif aux essais cliniques de médicaments.
Tout comme pour le règlement relatif aux dispositifs médicaux, le principe de primauté doit conduire la France à supprimer toute disposition nationale qui entre en concurrence ou en contradiction avec le Règlement (UE) n°536/2014.
Il convient donc de supprimer sans tarder le 1er alinéa de l’article R. 1121-1-1 du CSP et de faire disparaitre de tous textes légaux ou réglementaires la notion de « RIPH portant sur un médicament ».
Cette clarification facilitera la compréhension du cadre juridique applicable aux essais cliniques de médicaments à usage humain, par l’ensemble des acteurs français et étrangers de ces recherches.
⇒ Thomas ROCHE, Avocat associé





